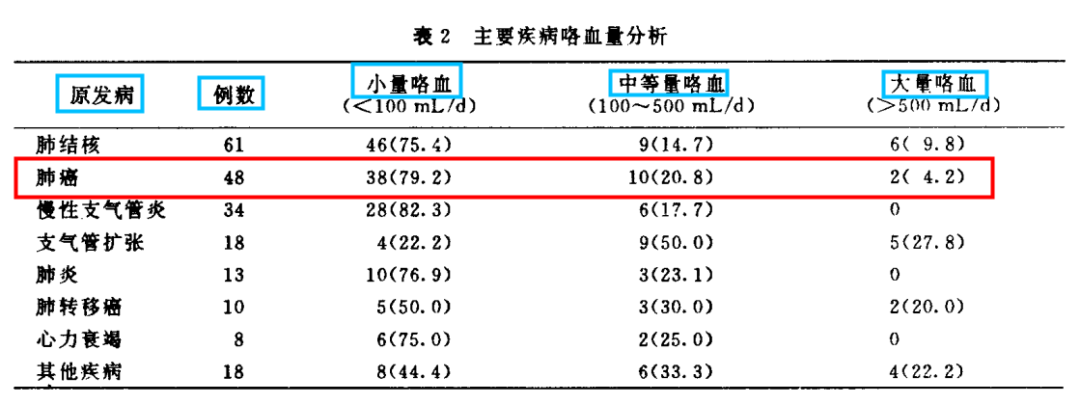
辅助化疗(EGFR 突变阴性) 1. Ⅰ期肿瘤完全切除术后定期随访,不推荐进行辅助化疗。对于ⅠB期存在高危因素的患者,综合评估后可考虑术后辅助化疗。 2. Ⅱ~ⅢB期NSCLC患者,肿瘤完全切除术后推荐进行辅助化疗。 术后辅助化疗推荐4周期,一般在术后4-6周开始,最晚不超过术后3个月。 辅助靶向治疗(EGFR 突变阳性) 3. ⅠA期肿瘤完全切除术后定期随访,不推荐进行辅助化疗; 4. ⅠB-ⅢB期肿瘤完全切除术后,推荐EGFR‐TKI(优选奥希替尼)辅助治疗。 5. 未接受辅助化疗,术后10周内开始EGFR‐TKI辅助治疗;接受辅助化疗,EGFR‐TKI辅助治疗不晚于术后26周。 辅助放疗 6. Lung ART研究:PORT没有显著改善IIIAN2期患者的生存获益,并增加心肺毒性 7. 对于NSCLC(N0-N2)患者肿瘤完全切除术后,不推荐行辅助放疗。 尽管其他恶性肿瘤如乳腺癌、结直肠癌等的术后辅助化疗发展的轰轰烈烈,确立了明显的优势地位,但在NSCLC领域,直到2004年,IALT研究证实辅助化疗能改善患者的5年OS,初步确立了化疗的地位。 1. 辅助化疗是目前应用最为广泛的辅助治疗手段,但副作用较大,生存获益相对有限(5 年生存率提高约5%),因此NSCLC患者肿瘤完全切除术后进行辅助化疗前需综合评估辅助化疗的收益和风险。对于PS评分>2分、肝肾功能异常(实验室指标超过正常值的2倍)、存在严重合并症或并发症、活动性感染、持续性发热、严重出血倾向、造血功能异常(血红蛋白<80 g/L,中性粒细胞<1.5×109/L、血小板<100×109/L)的NSCLC患者,不宜采用辅助化疗。 2. IB 期(高危)-III期患者术后辅助化疗可改善生存,辅助化疗的方案推荐采用以顺铂为基础的双药方案,对于无法耐受顺铂的患者,可采用卡铂为基础的双药方案。辅助化疗时机:一般在术后4~6 周开始,建议最晚不超过手术后3 个月。术后辅助化疗常规推荐4周期,更多化疗周期不会增加患者获益,反而可能增加不良反应。 3. 高危因素包括:低分化肿瘤(包括微乳头型腺癌、神经内分泌肿瘤等,但不包括分化良好的神经内分泌肿瘤)、脏层胸膜侵犯、脉管侵犯、气腔内播散等。 ADJUVANT研究(CTONG1104)[11]:一项随机、前瞻性、III期临床研究,分析了对于携带EGFR敏感突变且有淋巴结转移的患者,术后辅助吉非替尼治疗与标准化疗的疗效及安全性。2020年该研究最终OS结果发表于《JCO》杂志。 研究结果:1.OS:a. 数据截止时,全队列中位随访时间为80个月,ITT人群中(所有接受随机化的人群),靶向治疗组和化疗组的中位OS分别为75.5个月和62.8个月(HR=0.92,P=0.674),差异无统计学意义。5年OS率为53.2%和51.2%(P=0.784)(图2A)。b. 在PP人群中(接受随机化后至少接受1周期研究药物治疗的人群),两组中位OS分别为75.5个月和62.8个月(HR=0.92,P=0.686)。两组5年生存率分别为53.2%和50.7%(P=0.731)(图2B)。预设的亚组分析,包括年龄、性别、淋巴结转移状态[N1和N2的患者,HR值分别为0.97和0.92,这提示即使是N2的患者,也不能从术后辅助靶向治疗中获益]及EGFR基因突变状态,均未发现获益的亚组人群(图2C)。c. 在接受吉非替尼治疗的患者,N1及N2患者5年OS率分别为61.4%和49.3%。 图1:患者基线特征 图2:OS ITT人群DFS PP人群DFS 小结:在早期非小细胞肺癌且携EGFR敏感突变的患者,术后辅助吉非替尼治疗改善了DFS,但是并未转化为患者OS的获益,与历史对照相比,患者获得了较好的OS数值。 ITT人群DFS PP人群DFS DFS 安全性 II-IIIA期患者的DFS 整体人群的DFS(IB-IIIA期) 疾病复发或死亡的亚组分析 无CNS患者疾病生存期 Lung ART研究[14]:一项随机III期临床研究,旨在探索术后适形放疗(PORT)对完全性手术切除的N2期NSCLC患者的疗效和安全性。研究共纳入了501位患者,随机分配至PORT组(n=252)和对照组(不接受PORT,n=249)。患者中位年龄为61岁,66%为男性,73%为腺癌,96%之前接受过辅助化疗。主要终点是无病生存期(DFS),次要终点包括总生存期(OS)、复发模式、局部复发、出现第二肿瘤和治疗相关毒性等。 DFS OS 死亡原因 参考资料 [1]中国抗癌协会肺癌专业委员会, 中华医学会肿瘤学分会肺癌学组, 中国胸部肿瘤研究协作组. Ⅰ~ⅢB期非小细胞肺癌完全切除术后辅助治疗指南(2021版) [J] . 中华医学杂志, 2021, 101(16) : 1132-1142. DOI: 10.3760/cma.j.cn112137-20210210-00406. [2]ArriagadaR, Bergman B, Dunant A, et al. Cisplatin-based adjuvant chemotherapy inpatients with completely resected non-small-cell lung cancer. N Engl J Med.2004 Jan 22;350(4):351-60. doi: 10.1056/NEJMoa031644. [3]ArriagadaR, Dunant A, Pignon JP, et al. Long-term results of the international adjuvantlung cancer trial evaluating adjuvant Cisplatin-based chemotherapy in resectedlung cancer. J Clin Oncol. 2010 Jan 1;28(1):35-42. doi:10.1200/JCO.2009.23.2272. [4]WintonT, Livingston R, Johnson D, et al. Vinorelbine plus cisplatin vs. observationin resected non-small-cell lung cancer. N Engl J Med. 2005 Jun23;352(25):2589-97. doi: 10.1056/NEJMoa043623. [5]ButtsCA, Ding K, Seymour L, et al. Randomized phase III trial of vinorelbine pluscisplatin compared with observation in completely resected stage IB and IInon-small-cell lung cancer: updated survival analysis of JBR-10. J Clin Oncol.2010 Jan 1;28(1):29-34. doi: 10.1200/JCO.2009.24.0333. [6]DouillardJY, Rosell R, De Lena M, et al. Adjuvant vinorelbine plus cisplatin versusobservation in patients with completely resected stage IB-IIIA non-small-celllung cancer (Adjuvant Navelbine International Trialist Association [ANITA]): arandomised controlled trial. Lancet Oncol. 2006 Sep;7(9):719-27. doi: 10.1016/S1470-2045(06)70804-X. [7]StraussGM, Herndon JE 2nd, Maddaus MA, et al. Adjuvant paclitaxel plus carboplatincompared with observation in stage IB non-small-cell lung cancer: CALGB 9633with the Cancer and Leukemia Group B, Radiation Therapy Oncology Group, andNorth Central Cancer Treatment Group Study Groups. J Clin Oncol. 2008 Nov1;26(31):5043-51. doi: 10.1200/JCO.2008.16.4855. [8]PignonJP, Tribodet H, Scagliotti GV, et al. Lung adjuvant cisplatin evaluation: apooled analysis by the LACE Collaborative Group. J Clin Oncol. 2008 Jul 20;26(21):3552-9.doi: 10.1200/JCO.2007.13.9030. [9]KreuterM, Vansteenkiste J, Fischer JR, et al. Randomized phase 2 trial on refinementof early-stage NSCLC adjuvant chemotherapy with cisplatin and pemetrexed versuscisplatin and vinorelbine: the TREAT study. Ann Oncol. 2013 Apr;24(4):986-92.doi: 10.1093/annonc/mds578. [10]KreuterM, Vansteenkiste J, Fischer JR, et al. Three-Year Follow-Up of a RandomizedPhase II Trial on Refinement of Early-Stage NSCLC Adjuvant Chemotherapy withCisplatin and Pemetrexed versus Cisplatin and Vinorelbine (the TREAT Study). JThorac Oncol. 2016 Jan;11(1):85-93. doi: 10.1016/j.jtho.2015.09.014. [11]Zhong WZ, Wang Q, Mao WM, et al. Gefitinib Versus Vinorelbine Plus Cisplatin as Adjuvant Treatment for Stage II-IIIA (N1-N2) EGFR-Mutant NSCLC: Final Overall Survival Analysis of CTONG1104 Phase III Trial. J Clin Oncol. 2021 Mar 1;39(7):713-722. doi: 10.1200/JCO.20.01820. [12]Yue D, Xu S, Wang Q, et al. Erlotinib versus vinorelbine plus cisplatin as adjuvant therapy in Chinese patients with stage IIIA EGFR mutation-positive non-small-cell lung cancer (EVAN): a randomised, open-label, phase 2 trial. Lancet Respir Med. 2018 Nov;6(11):863-873. doi: 10.1016/S2213-2600(18)30277-7. [13]Wu YL, Tsuboi M, He J,et al. Osimertinib in Resected EGFR-MutatedNon-Small-Cell Lung Cancer. N Engl J Med. 2020 Oct 29;383(18):1711-1723. doi:10.1056/NEJMoa2027071. [14]An international randomized trial, comparing post-operative conformal radiotherapy (PORT) to no PORT, in patients with completely resected non-small cell lung cancer (NSCLC) and mediastinal N2 involvement: Primary end-point analysis of LungART (IFCT-0503, UK NCRI, SAKK) NCT00410683.
术后辅助治疗篇概要[1]
辅助化疗
小结:

辅助靶向治疗





EVAN研究



EVIDENCE研究

研究结果:1)DFS:埃克替尼治疗组中位DFS为46.95个月,标准辅助化疗组中位DFS为22.11个月(HR=0.36,95%CI 0.24-0.55,p<0.0001);DFS亚组分析结果显示埃克替尼均优于标准辅助化疗。埃克替尼治疗组和标准辅助化疗组3年DFS率分别为63.88%和32.47%。5年DFS率时间尚未达到。2)OS:EVIDENCE研究OS还未达到(ADJUVANT研究OS未获益)。3)安全性:埃克替尼治疗组不良反应发生率明显低于标准辅助化疗组;3级及以上不良反应发生率为4.5% vs 59.7%。埃克替尼组患者常见不良反应为皮疹、转氨酶升高;化疗组常见不良反应为恶心、呕吐、转氨酶升高及血液毒性等。


ADAURA研究




辅助放疗
非小细胞肺癌,术后放疗系列研究汇总